Aplicación de células madre en
implantes dentales
Diferenciación de células madre
La
diferenciación es una de las fases más importantes del proceso de regeneración
de tejidos, debido a que depende de esta fase el rumbo que puedan tomar las
células madre mesenquimales, es decir, a qué tipo de células darán origen,
existen diversas posibilidades como: células de origen mesodérmico como
condrocitos (Pittenger & cols, 1999) , osteoblastos (Pittenger & cols, 1999) (Rodríguez-Lozano & cols, 2012) , adipocitos (Pittenger & cols, 1999) , mioblastos (Wakitani & cols, 1995) , células de tendón (Altman & cols, 2002) , odontoblastos (Gronthos & cols, 2000) , (Miura & cols, 2003) y cementoblastos (Kemoun & cols, 2007) . Hace unos años se
pensaba que las células adultas solo podían diferenciarse en un solo tipo de
célula, sin embargo con los años se demostró que después de un proceso a una
célula adulta se le puede inducir pluripotencialidad.
Las células madre pluripotentes inducidas (induced pluripotent stem cells, células iPS) son células somáticas adultas reprogramadas hacia un estadio pluripotente similar al de las células madre embrionarias (embryonic stem cells, ESC). Este descubrimiento ha generado gran expectativa dado el potencial de estas células en la comprensión y tratamiento de un amplio rango de enfermedades y ha aumentado, asimismo, el interés por los mecanismos implicados en la reprogramación del núcleo celular.
Las células madre pluripotentes inducidas (induced pluripotent stem cells, células iPS) son células somáticas adultas reprogramadas hacia un estadio pluripotente similar al de las células madre embrionarias (embryonic stem cells, ESC). Este descubrimiento ha generado gran expectativa dado el potencial de estas células en la comprensión y tratamiento de un amplio rango de enfermedades y ha aumentado, asimismo, el interés por los mecanismos implicados en la reprogramación del núcleo celular.
La manera más directa de inducir pluripotencia es
mediante la transducción de células somáticas con factores de transcripción
capaces de producir la reprogramación del núcleo celular. En el trabajo pionero
de Takahashi y Yamanaka (2006), se identificaron cuatro factores que eran
suficientes para inducir pluripotencia en fibroblastos: Oct4, Sox2, Klf4 y
c-Myc (OSKM).
INFECCIÓN CON VECTORES LENTIVIRALES O RETROVIRALES
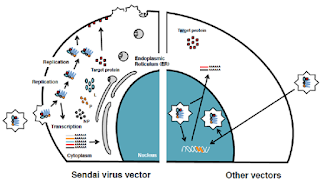
Uno de los
métodos no integrativos más prometedores se basa en la utilización del virus
Sendai. El sistema provisto por el Cyto Tune –iPS Reprogramming System se basa
en la utilización de SeV replicación-incompetente para la expresión efectiva de
los factores de reprogramación en células somáticas. El kit utiliza virus que
son no-integrativos y permanecen en el citoplasma.
Representación
esquemática de los ciclos de vida de los SeV no integrativos (izq) y de otros
vectores virales integrativos (der). Figura modificada de la guía de usuario
CytoTuneTM-iPS Reprogramming Kit.
METODOLOGÍA
Las células
somáticas humanas se infectan durante aproximadamente 16 horas con concentrados
virales (sean lentivirus, retrovirus o virus Sendai) que contienen los cuatro vectores
OSKM. 1 a 7 días después de la infección, las células se plaquean sobre un
sostén celular de fibroblastos humanos irradiados (HFF) con medio de cultivo
específico para ESC humanas, que se cambiará cada 48 horas. Aproximadamente
15-25 días después, se pueden observar colonias con una morfología similar a
ESC que se pasarán cada una de ellas manualmente a placas con soportes
celulares de HFF. Tras ser expandidas se caracterizan mediante detección de
marcadores de pluripotencia y capacidad de diferenciación[1].
1.1.
Aplicación de células madre iPS
La reprogramación celular nos permite convertir cualquier célula del
cuerpo en una célula madre. Su descubrimiento en el 2006 sorprendió a muchos
científicos y cambió la manera de pensar sobre el funcionamiento de las
células. La reprogramación celular ha abierto excitantes posibilidades para
estudiar y tratar enfermedades.
El descubrimiento de las
iPS
En 2006, Shinya Yamanaka
hizo un descubrimiento sorprendente que le llevó a ganar el Premio Nobel en
Fisiología o Medicina tan solo 6 años después: encontró una nueva manera de
“reprogramar” células especializadas adultas para convertirlas en células
madre. Éstas células madre de laboratorio son pluripotentes (pueden dar lugar a
cualquier tipo de célula del cuerpo) y se llaman células madre pluripotentes
inducidas, o células iPS. Sólo las células madre embrionarias son de naturaleza
pluripotente. El descubrimiento de Yamanaka significa que cualquier célula del
cuerpo en división puede ahora convertirse en una célula madre pluripotente.
Entonces, ¿Cómo se
obtienen estas células iPS? Yamanaka añadió cuatro genes a células de la piel
provenientes de ratón. Este hecho inició un proceso en el interior de las
células llamado reprogramación y, en un periodo de 2-3 semanas, las células de
la piel se transformaron en células madre pluripotentes. Ahora, los científicos
pueden también hacer esto con células humanas, añadiendo incluso menos de
cuatro genes.
Células iPS y células madre embrionarias
Las células
iPS y las células madre embrionarias (células ES) son bastante similares. Son
capaces de renovarse a sí mismas, es decir, pueden dividirse y producir copias
de sí mismas indefinidamente. Ambos tipos de células madre pueden ser usadas
para obtener casi cualquier tipo de célula especializada bajo unas condiciones
controladas en el laboratorio. Las células iPS y las células madre embrionarias
pueden ayudar al entendimiento de cómo las células especializadas se
desarrollan a partir de células pluripotentes. En el futuro, estas células
podrían también suponer un suministro ilimitado de células y tejidos de
reemplazo para muchos pacientes con enfermedades actualmente incurables.
Al contrario de
las células madres embrionarias, obtener células iPS no depende del uso de
células de un embrión temprano. ¿Hay otras diferencias? Investigaciones
recientes indican que algunos de los genes en las células iPS se comportan de
manera diferente a aquellos que encontramos en las células madre embrionarias.
Esto se debe a la reprogramación incompleta de las células y/o a los cambios
genéticos adquiridos por las células iPS cuando crecen y se multiplican. Los
científicos están estudiando esto en más detalle para descubrir cómo estas
diferencias pueden afectar al uso de las células iPS en investigación básica y
aplicaciones clínicas. Es necesario una investigación más exhausta para
entender cómo se produce la reprogramación dentro de la célula. Así que en este
momento, muchos científicos creen que no se pueden reemplazar las células ES
por las iPS en la investigación básica.
Células iPS – desarrollo y
aplicaciones: Ciertos genes pueden ser introducidos en células adultas para
reprogramarlas. Las células iPS resultantes se parecen a las células madre
embrionarias y pueden diferenciarse en cualquier tipo de célula para estudiar.
Células iPS y enfermedad
Un importante
paso en el desarrollo de una terapia para una enfermedad determinada es el
conocimiento exacto de cómo funciona dicha enfermedad: ¿qué funciona mal
exactamente en el cuerpo? Para hacer esto, los investigadores necesitan
estudiar las células o los tejidos afectados por la enfermedad, pero esto no es
siempre tan simple como suena. Por ejemplo, es casi imposible obtener células
cerebrales genuinas de pacientes con la enfermedad de Parkinson, especialmente
en estadíos tempranos de la enfermedad antes de que el paciente desarrolle algún
síntoma. La reprogramación celular significa que los científicos pueden ahora
acceder a un gran número de neuronas de un tipo particular (células cerebrales)
que están afectadas por la enfermedad de Parkinson. Los investigadores primero
generan células iPS a partir, por ejemplo, de biopsias de piel de pacientes con
Parkinson, y luego usan éstas células iPS para producir neuronas en el
laboratorio. Las neuronas tienen el mismo fondo genético que las células de los
propios pacientes. Así, el científico puede trabajar directamente con neuronas
afectadas por la enfermedad de Parkinson en una placa y estudiar qué va mal en
las células y porqué. Los modelos celulares de enfermedades como este pueden
también usarse para buscar y testar nuevos fármacos para tratar o proteger a
los pacientes contra la enfermedad.
Futuras aplicaciones y retos de las células
iPS
La
reprogramación celular tiene un gran potencial para el desarrollo de nuevas
aplicaciones médicas, como las terapias de reemplazamiento celular. Como las
células iPS provienen del propio paciente, pueden ser usadas para cultivar
células especializadas que son completamente compatibles con el paciente y que
no serán rechazadas por el sistema inmune. Si el paciente tiene una enfermedad
genética, el problema genético puede ser corregido en sus células iPS en el
laboratorio, y utilizarse para producir una remesa de células especializadas
sanas específicas de paciente para transplante. Pero su beneficio es solo
teórico por ahora.
Hasta hace
poco, generar células iPS implicaba cambios genéticos permanentes en el
interior celular, lo que podía causar la formación de tumores. Los científicos
han desarrollado ahora métodos para generar células iPS sin esta modificación
genética. Estas nuevas técnicas son un paso importante hacia la generación de
células especializadas derivadas de iPS de forma segura para su uso en
pacientes. Una investigación más exhaustiva es ahora necesaria para el completo
entendimiento de cómo funciona la reprogramación celular y cómo las células iPS
pueden ser controladas y producidas de la forma más consistente posible para
alcanzar los requerimientos de seguridad y alta calidad para su uso en la
clínica. (Hadenfeld, Peitz, & Pusch,
2012)
II.
Implantes dentales y células madre
2.1. ¿Qué son los implantes
dentales?
Se
denomina implante dental al dispositivo o unidad protésica que tiene como
función reemplazar a un diente, parcial o totalmente, y que está constituido de
un material biológicamente inerte (biocompatible), como el titanio o el óxido
de zirconio. La biocompatibilidad es importante para que los tejidos vivos acepten
el implante dentro del cuerpo humano e implica que haya ausencia de corrosión,
deterioro del material, respuestas inflamatorias no deseables, muerte del
tejido
adyacente
al implante, aumento de anticuerpos, mutación celular, aparición de células
cancerígenas, entre otros aspectos.
Dada
la amplia variedad de implantes dentales actuales, estos pueden agruparse en
dos grandes grupos: endo-óseos y yuxta-óseos.
Tipos de implantes:
2.1.1.
Implantes dentales
yuxta-óseos:
Introducidos
en 1940, estos implantes no penetran el hueso sino que recubren su superficie.
Son puestos bajo la mucosa, reposando sobre el maxilar o la mandíbula. Dado que
son elementos metálicos hechos a medida, requieren un trabajo previo de
laboratorio de prótesis, pues se desarrollan a partir de modelos del maxilar.
Generalmente, están hechos en aleaciones de cromo, cobalto y molibdeno, y en
ocasiones están recubiertos de cerámica o carbono.
Están
recomendados para pacientes cuya altura ósea es demasiado poca como para poner
un implante endo-óseo y no puede usarse las dentaduras convencionales.
2.1.2.
Implantes dentales endo-óseos:
Todos
aquellos implantes que para su introducción es necesario despegar la mucosa
oral y penetrar la estructura ósea del paciente, son denominados implantes
endo-óseos. Estos implantes pueden ser de material metálico, cerámico, carbón
vitrificado, material orgánico o material semi-biológico. Los implantes
dentales endo-óseos pueden clasificarse en cuatro grupos: cilíndricos,
roscados, a lámina y de cresta delgada.
2.1.2.1. Implantes endo-óseo cilíndricos:
Los
más usados presentan aspecto de tornillo, con una superficie roscada que
aumenta la superficie de contacto entre el implante y el hueso. También se
encuentran los de superficie no roscada cubierta de hidroxiapatita[2],
estos presentan perforaciones que tienen como objeto la mejora de la
osteointegración en la interfase hueso-implante. Con esto se ocasiona que el
hueso se desarrolle en el interior del implante y se fije por retención
mecánica. Dado el lento proceso que esto implica, no son muy usados.
2.1.2.2. Implantes endo-óseos a lámina:
Ideado
por L. Linkow, presentan la gran ventaja de evitar una segunda intervención,
llegando a terminar su colocación en una sola sesión. Son especialmente
recomendados para reemplazar incisivos del maxilar superior, siempre que el
hueso sea bastante ancho y profundo, aunque en ningún caso se recomienda su uso
para pacientes con edentación[3]
total de maxilar superior o inferior.
2.1.2.3. Implantes endo-óseos de cresta delgada:
Ideados
por M. Cherchève, requiere de menos instrumentación y suele no presentar
peligros para el paciente, dada su mayor facilidad de instalación. La cabeza
del fuste, es decir el pilar donde se fija la prótesis, tiene buenas
condiciones de apoyo en el hueso cortical y de inserción por sellado, sin
necesidad de emplear algún cemento o resina.
2.2. Aporte de las células madre en los implantes
dentales
La
problemática de los implantes dentales desde su origen fue la fijación de
estos, por ello surgió la idea del apoyo de los implantes con la
oseointegración, pero los seres humanos seguimos siempre con una constante
investigación por ello surge la idea también de utilizar células madre en este
proceso, debido a que se podría regenerar parte del periodonto o algún tejido
que le pueda dar un sostén muy expectante. Sin embargo la inclusión de células
madre generó todo un debate ético debido a su localización y a las creencias
antiguas de la localización de estas únicamente en embriones, hace
muchos años atrás diversos científicos comenzaron a dar diferentes soluciones
para su localización en lugares fácilmente ubicables y accesibles como en la
pulpa dental (Gronthos & cols, 2000) , ligamento periodontal,
(Gronthos & cols, 2000) dientes deciduos (Miura & cols, 2003) , periostio (Nakahara & cols, 1991) , membrana sinovial (Bari & cols, 2001) , músculo (Bosch & cols, 2000) , grasa (Zuk & cols., 2002) , dermis (Young & cols., 2001) , y hueso trabecular (Tuli & cols., 2003) . Pero en el año 2012
el Dr. Mao de la Universidad de Columbia realizó un estudio con la colaboración
de diversos especialistas en el tema y llegó a la conclusión de que la
localización de las células madre mesenquimales de la pulpa dental las cuales
poseen el mayor porcentaje de éxito durante el proceso, no es tan fácil debido
a que “pueden no estar disponibles
en un paciente que está en necesidad de terapia de regeneración de pulpa /
dentina. Incluso si se dispone de células madre de pulpa dental autóloga o
quizás allogeneically, hay que abordar una multitud de científicos, barreras
regulatorias y de comercialización, ya menos que se resuelvan estas cuestiones,
trasplante de células madre de pulpa dental seguirá siendo un ejercicio
científico, en lugar de una realidad clínica. Estas barreras incluyen el
aislamiento celular, manipulación ex vivo con el potencial para cambiar el
fenotipo celular, y cuestiones de seguridad incluyendo inmunorrechazo,
potencial la contaminación, la transmisión de patógenos y la tumorigénesis.
Costes excesiva asociada con todo de éstos, además de transporte,
almacenamiento, manejo de asuntos y temas regulatorios incluyendo vía clara e
incapacidad general para asegurar la consistencia de lote a lote en la calidad
celular, abarrotado de preguntas multidimensionales para la viabilidad de este
enfoque.” (Regenerative
Endodontics: Barriers and Strategies for Clinical Translation). (Mao, y otros, 2012)
Sin embargo el Dr. Jeremy Mao ideó una técnica en la que los implantes podrían cultivarse en un alveolo dentario
(divisiones en
compartimentos que presenta el hueso alveolar donde van insertados los dientes, separados entre sí por un
tabique inter-alveolar óseo)
vacío, justo dentro de la boca del paciente.
El Dr. Jeremy Mao comenzó la construcción de un sacaffold en forma de
diente de materiales naturales microchannelled, infundido con un factor de
crecimiento. En un estudio en animales, colocó esa estructura en alveolo dentario
vacío de un destinatario, a continuación, colocó células madre en el scaffold.
El resultado no sólo se obtuvo en el crecimiento de una nueva estructura de
diente, sino también en la regeneración de ligamentos periodontales y la
formación de nuevo hueso alveolar.
El Dr. Mao cree que un diente completo podría ser cultivado en tan sólo
nueve semanas. Anteriormente, como "diente de crecimiento" habría
requerido el uso de células madre recolectadas, y tendría que hacerse en un
entorno externo, tal como una placa de Petri. Al crecer dentro de la cavidad
del diente, el implante se integra con el tejido circundante de una manera que
de otra forma sería imposible. Debido a que está hecho logra que de las propias
células del receptor, se regenerara de forma continua e incluso podría durar
toda su vida.
La investigación de la Universidad de Columbia podría significar la
diferencia para ciertos pacientes. "Una consideración clave en la
regeneración de dientes es encontrar un enfoque rentable que puede traducirse
en terapias para pacientes que no pueden pagar o que no son buenos candidatos
para los implantes dentales," dijo el Dr. Mao. "La regeneración de
dientes a base de células-homing puede proporcionar una vía tangible hacia la
traducción clínica”.
En el año 2015 se realizó un experimento similar pero en cerdos bebé, es
decir, se aislaron células madre dentales a partir de yema de dientes de cerdos
bebé.”La citometría de flujo
reveló que la mayoría de las células proliferantes fueron positivas para marcadores
de superficie de células madre, incluyendo CD105, CD29, CD44, CD71. Estas
células madre dentales fueron luego sembradas en gel de agarosa biodegradable
para autoinjerto en varias áreas del hueso de la mandíbula. Cerdos bebé con los
brotes de dientes removidos sin el trasplante de células madre dentales sirvió
como control. Después de un año, se formaron coronas del diente bien
diferenciado y vaina radicular en mini cerdos en el grupo experimental. El
diente formado por las células madre dentales trasplantados en el hueso
alveolar fue similar en tamaño a la corona original de diente (aproximadamente
2 cm x 2 cm x 2 cm). Los dientes formados por las células madre dentales
trasplantados bajo las raíces de los dientes anteriores y en el área de hueso cortical
eran más pequeñas. En el grupo control, se observó el espacio donde el brote
diente se extrajo sin trasplante de células a ser cerrado por el movimiento
hacia adelante de los dientes posteriores. El análisis histológico mostró las
estructuras del esmalte, dentina y pulpa en la corona del diente regenerado. El
análisis inmunohistoquímico de amelogenina, colágeno tipo I y el hueso
sialoproteína esmalte confirmado y la formación de la dentina. Estructuras
esmalte y la dentina en el diente regenerada también se identificaron mediante
microscopía electrónica de barrido. Estos hallazgos demuestran un modelo de
éxito de la regeneración de dientes a partir de células madre dentales en mini
cerdos. Además, el medio ambiente local y espacio disponible también afectan
significativamente el grado de regeneración de los tejidos. Nuestro estudio
demuestra la viabilidad de usar las células madre dentales para la regeneración
de dientes en aplicaciones clínicas.”(TOOTH REGENERATION WITH DENTAL STEM CELL
RESEARCH IN MINIATURE PIG MODEL) (Tzong-Fu
& J. Taiwan Vet , 2015)
[1]
“Reprogramación y Diferenciación Celular”. http://www.inbiomed.org/Index.php/plataformas_tecnologicas/reprogramacion_celular;
2014.
[2] El mineral hidroxiapatita (Ca10
(PO4)6 (OH)2), constituye entre el 60% y 70% del
peso seco del tejido óseo. De hecho, el esmalte dental contiene este mineral,
de ahí su importancia en el uso de implantes dentales.
[3] Ausencia de dientes.








No hay comentarios:
Publicar un comentario